组蛋白是细胞核内与DNA紧密结合的碱性蛋白质。科学家早已知晓组蛋白可以帮助调节基因,而它们的作用可能远不止于此。
在我们呼吸、睡觉、用餐和日常生活中的每一秒,体内的细胞都会发生数百万次生化反应。在这些纷纷扰扰的化学物质交换中,有些反应会将碳分子附着到蛋白质、脂肪、DNA 等物质上(或从中去除)。添加或去除这些小分子对于许多使细胞得以存活、生长和分裂的化学反应至关重要。
在这些增减活动中,最有趣且研究最深入的目标可能位于细胞核内。在这里,各种酶将两个小分子——甲基团(由一个碳原子和三个氢原子构成)和乙酰基团(由两个碳原子、三个氢原子和一个氧原子构成)——附着到组蛋白上,或者将其从组蛋白上移除。组蛋白是DNA缠绕的蛋白质线轴。
复杂细胞的组蛋白被命名为H2A、H2B、H3和H4。它们组装成八个一组,外裹一段DNA,形成名为核小体的结构,并顺着染色体长度重复排列。组蛋白有长长的尾巴,酶可以将甲基团和乙酰基团等代谢物附着到这上面
几十年来,人们一直认为在组蛋白上添加或去除甲基团或乙酰基团是决定基因何时何地被激活的关键。
但越来越多的证据表明,这只是故事的一部分。尽管在基因组的某些地方,将甲基团和乙酰基团添加到组蛋白上会对附近的基因活性产生密切影响,但在许多其他区域,它根本毫无作用。这表明调节基因活性并不是这些组蛋白修饰的唯一功能,甚至可能不是主要功能。
事实上,新兴研究表明,这些组蛋白修饰在细胞的生化过程中起着关键作用(即代谢作用),为细胞处理生化反应中产生的碳分子提供了一种方式。
研究人员指出,组蛋白对于乙酰基团而言扮演着类似“银行”或“储存库”的角色,当细胞需要更多的乙酰基来进行化学反应时,就能从中提取。
对于甲基团,研究人员则认为组蛋白充当了“水槽”的角色,甲基团可以暂存此处,这样就不会干扰化学反应。如果没有这个水槽,许多需要摆脱甲基团才能进行生化过程下一步的分子就会处于停滞状态,从而给细胞带来问题。
组蛋白曾被认为只是基因的结构支架,能让DNA链有序排列。后来,人们认为它们参与基因控制——促进或者阻止DNA的展开,使其可以被复制。现在,若这项新研究进展顺利,组蛋白将被证明与细胞的代谢运作密切相关。
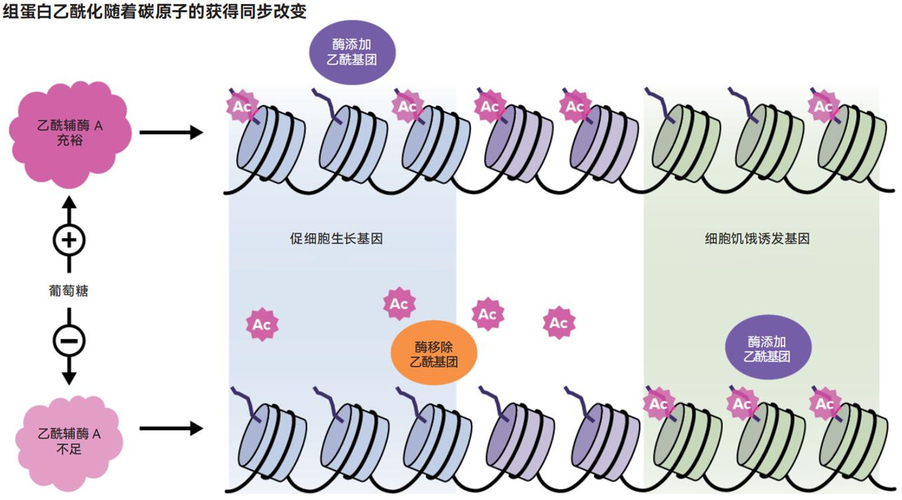
上图描绘了不同细胞条件下乙酰基团的运动模型。当能量充足且线粒体全速运转时,乙酰基团会大量存在并附着在促进细胞生长的基因的组蛋白尾端上。当“食物”变得稀缺时,细胞会通过消耗这些乙酰基团来获取能量。剩余的乙酰基团会重新排列以激活那些与增加细胞中乙酰辅酶A含量有关的基因
科学家表示,这可能有助于揭示组蛋白的进化方式及其背后原因。
提示“丰饶季”
十多年前,得克萨斯大学西南医学中心的生物化学家本杰明 · 屠(Benjamin Tu)在实验室中培养酵母细胞时发现了一些有趣的现象:超过1000个基因的活性与细胞消耗的氧气量同步波动,基因活性和代谢活动协同变化。
屠还观察到,当涉及细胞生长的基因活性达到顶峰时,其组蛋白上恰好附着着大量的乙酰基。而当基因在细胞周期的下一阶段沉默时,乙酰基团也随之消失。屠评价说:“这让人非常兴奋。”
这种现象令人兴奋是因为乙酰基团是由线粒体(能够产生能量的细胞器)产生的。细胞利用乙酰基团来制造脂肪酸等分子,这些分子用于提供能量或构建细胞膜。乙酰基团似乎是线粒体向细胞核发出的信号,表明现在是丰饶季,有大量可用的能量和化学构件。通过附着在组蛋白上,它们增强了涉及细胞生长的基因的活性。毕竟,在物资充足期生长和分裂是说得通的。
屠还发现,组蛋白上的乙酰基也可以充当“银行”的角色,作为细胞在困难时期的能量来源。他观察到,当细胞处于饥饿状态时,细胞内一种名为乙酰辅酶A的重要化学物质(在能量生成中发挥核心作用)的含量会减少。为了产生能量,细胞会消耗从组蛋白上脱离的乙酰基团。剩余的乙酰基团则会重新排列,从而激活细胞内能够产生更多乙酰辅酶A的基因。
屠研究组的其他工作表明,组蛋白在代谢途径中可能发挥着更为重要的作用,这次涉及甲基团。科学家在酵母中研究了一种携带甲基团的化学物质——S-腺苷甲硫氨酸,简称为SAM。当SAM释放一个甲基团时,它会变成制造半胱氨酸所需的一种化学物质。但当细胞没有地方释放甲基团时,半胱氨酸的生成量会减少,进而影响细胞的生长能力。组蛋白则充当了这些甲基团的接收者。
维系新陈代谢
2023年的一项研究为组蛋白的代谢作用提供了更多证据。在该研究中,牛津大学生物化学家彼得 · 萨基斯(Peter Sarkies)和他的同事马科斯 · 弗朗西斯科 · 佩雷斯(Marcos Francisco Pérez)研究了大量不同的酶,这些酶都能将甲基团添加到组蛋白上。
每种酶都会将甲基团放在组蛋白上的一个独特位置——组蛋白尾端的松散部位。甲基团附着的位置不同,对基因活性产生的影响也会不同,而这些影响包括活性激活、活性抑制和不产生任何变化。萨基斯推断,如果只是试图让甲基团不要挡路,以便新陈代谢能够继续进行,那么重要的不是任何单一酶或对附近基因产生的特定影响,而是所有这些酶的总活性。
这正是该研究团队在检验大量癌细胞系时发现的。每个细胞系都提高或降低了不同组合的甲基化酶活性,从而得以让甲基团沉积在组蛋白上,确保新陈代谢的快速进行。
科学家还发现,许多甲基化酶都受到一种名为Rb的基因的影响,这种基因常在癌细胞中发生突变,并因其抑制癌症的作用而闻名。这让萨基斯认为,Rb在提高或降低甲基团在组蛋白上的沉积速率、从而调节细胞生化途径和生长方面起着核心作用。萨基斯说:“我们发现,细胞不仅利用组蛋白甲基化来调节基因,还用来调节代谢。”
更多可能性
研究人员最近还了解到,组蛋白有时也会参与其他细胞生物化学过程。在2017年发表的一项研究中,巴塞罗那约瑟夫 · 卡雷拉斯白血病研究所的染色质生物学家马库斯 · 布施贝克(Marcus Buschbeck)的研究团队表明,名为macroH2A1.1的组蛋白可以帮助保存一种名为NAD+辅酶的化学物质,该物质在许多生化反应中都不可或缺。这也使得线粒体可以使用更多的NAD+辅酶来产生能量。
加州大学洛杉矶分校的生物化学家西亚瓦什 · 库尔德斯坦尼(Siavash Kurdistani)的研究团队在2020年证实,组蛋白可以作为酶发挥作用,将氧化态的铜离子(Cu2+)转化为还原态的铜离子(Cu1+)。还原态的铜离子是线粒体产生能量所需的铜离子形式。在复杂真核细胞(就像我们自己的细胞)进化的初期,由于大气中氧气含量的增加,铜被氧化,致使还原态的铜离子很难获得。
随着组蛋白与代谢之间的联系被揭示出来,研究人员也在推测这种关系最初是如何出现的。他们注意到,在被称为古菌的微生物(真核细胞被认为是从这些微生物进化而来的)中存在着种类繁多的组蛋白。但是,其中很少有像我们自己的组蛋白那样具有松散尾端的,这些尾端是放置甲基和乙酰基标记的地方。因此,科学家对了解组蛋白在我们的古菌祖先中可能如何发挥作用很感兴趣。
大多数被称为古菌的单细胞生命体的组蛋白都没有尾端或尾端很短。但是,真核细胞(如我们自己的细胞)的组蛋白有长而松散的尾端,细胞可以将各种代谢物附着在上面
他们提出了多种可能性。库尔德斯坦尼认为,古菌组蛋白的早期作用可能是产生那些珍贵的还原态铜离子。伦敦帝国理工学院的染色质生物学家托拜厄斯 · 沃内克(Tobias Warnecke)研究了古菌中组蛋白的进化,他认为古菌组蛋白可能有助于防止DNA在极端环境(例如古菌生活的高温环境)中断裂。沃内克还补充道,组蛋白可能还保护了古菌DNA,防止病毒试图插入其中。
在大约15亿年前、如今真核生物的祖先出现之后,组蛋白进化出了更长的尾端,并以多种方式进行化学修饰,包括乙酰化和甲基化。屠认为,这些修饰可能是为了管理早期真核生物中线粒体产生的代谢物。线粒体产生的一些化学物质反应性很强,可能会自发地附着在DNA等重要分子上,并造成损害。也许细胞进化出了酶来将这些碳分子从有害的地方移除,并将其附着到像组蛋白尾端这种不会造成损害的地方。
后来,细胞可能就依赖于这些组蛋白修饰来进行自身代谢调节。
在此之后呢?组蛋白的进化史似乎就是一个调节再利用的故事。萨基斯认为,如果细胞最初无意间找到了一种利用组蛋白来调节代谢的方式,那么类似的过程可能也会导致它们利用组蛋白来控制基因。他表示:“对于组蛋白来说,代谢调节比基因调节更为基础。”
资料来源 Knowable Magazine